盘点癌症耐药最新研究进展!
肿瘤耐药是导致肿瘤治疗失败的主要原因之一,极大地限制了癌症药物的选择和使用,一次次打破癌症患者的希望。癌症耐药性研究至关重要,探索癌症耐药的机制和对抗耐药的新方法迫在眉睫。小编在此为大家盘点了癌症耐药研究最新进展,与大家一起学习。
【1】胰岛素通路竟会导致脑瘤耐药性!新发现带来抗癌新思路!
DOI: 10.1158/1535-7163.MCT-16-0616
多形性成胶质细胞瘤是最常见、死亡率最高的肿瘤之一。尽管各种先进的疗法在治疗初期具有疗效,但是肿瘤通常会产生耐药性并最终复发。近日,由Norris Cotton癌症研究中心Mark Israel实验室博士生Damian A. Almiron Bonnin领导的研究团队找到了一种防止脑癌对抗癌药物产生耐药性的新方法。
在这项研究中,我们成功地找到了一个导致多形性成胶质细胞瘤产生耐药性的信号通路。” Almiron Bonnin说道。“更重要的是,现在已经有药物可以抑制这条产生耐药性的信号通路。”
这项研究发现胰岛素信号通路在接受抗癌药物处理的脑癌细胞中扮演着肿瘤生长信号通路的角色,这就导致肿瘤可以在接受治疗的同时不断生长。这种情况下抑制胰岛素信号通路可以防止肿瘤产生耐药性。这种策略也许可以增强现有抗癌疗法的疗效,最终延长这种肿瘤患者的生存期。这项工作以“Insulin-Mediated Signaling Facilitates Resistance to PDGFR Inhibition in Proneural hPDGFB-Driven Gliomas”为题于近日作为封面文章发表在《Molecular Cancer Therapeutics》上。
“我们研究的肿瘤是儿童及成年人最常见、恶性程度最高的非转移性脑瘤。目前没有任何方法可以治愈这种肿瘤。” Almiron Bonnin说道。“因此,脑癌导致了约25%的癌症相关死亡。这种肿瘤会很快对治疗产生耐药性,因此现有的各种疗法效果大都很差。在我们的实验室中,我们尝试了解是什么在细胞水平介导了耐药性,这样我们可以开发出更有效的治疗方法。我们找到了导致耐药的信号通路中一个关键的组分,并提出了一种新策略解决这个问题。”
Almiron Bonnin的研究将帮助科研家们更深入地了解肿瘤耐药的机制,这将有可能帮助改善这种高级胶质瘤的临床治疗效果。展望未来,该研究团队将基于他们的新发现开发可能更有效的靶向治疗这种肿瘤的新方法。
【2】Cancer Cell:乳腺癌耐药性的分子机制
DOI: https://doi.org/10.1016/j.ccell.2018.01.004
最近,来自Dana-Farber癌症研究所的研究者们发现了ER阳性乳腺癌细胞对常规疗法产生耐受性以及恶化的分子机制,科学家们称这一研究解释了为什么ER基因突变的乳腺癌细胞在接受了芳香酶抑制剂以及他莫昔芬治疗之后产生耐受性以及变得更加容易恶化。而目前ER阳性的乳腺癌产生耐药性是临床上亟待解决的问题。
大部分乳腺癌患者体内的肿瘤细胞依赖雌激素得以存活。而大部分药物都是通过阻止雌激素的产生或者阻断癌细胞中雌激素受体起到抑制癌症生长的效果。这种内分泌疗法,包括他莫昔芬以及芳香酶抑制剂药物在内,能够抑制早期乳腺癌的复发,也能够延缓恶性癌症的严重化趋势。然而,三分之一的ER阳性乳腺癌患者在接受上述药物治疗之后仍会出现复发的现象,而且复发的癌细胞在没有雌激素的情况下还能够生长,因此导致耐药性的产生。
在这项研究中,作者发现ER基因突变中三种存在此前不为人熟知的作用。这些突变不仅仅会导致其在雌激素缺失的情况下能够存活,而且能够启动其它基因的表达,从而促进肿瘤的恶化与转移。
利用CRISPR-Cas9基因编辑工具,作者鉴定出了对于ER突变十分重要的基因。在这些重要的基因中,CDK7格外受到研究者们的重视,原因在于其实一个潜在的药物靶点。事实上,Nathanael Gray博士等人此前开发出了实验性的CDK7抑制剂THZ1。细胞水平以及动物模型水平的研究结果表明联合使用THZ1以及内分泌抑制剂fulvestrant能够延缓肿瘤的生长,其效果明显强于单独使用上述药物。
“这些结果表明联合药物疗法能够解决ER阳性乳腺癌耐药性的问题。”作者们说道。
【3】Nat Commun:科学家在克服肿瘤多药耐药性上取得突破性进展
DOI: 10.1038/s41467-018-02915-8
肿瘤细胞对化疗产生耐性性——俗称多药耐药性——仍然是肿瘤复发和癌症转移的主要原因,但是最近的发现为肿瘤学家们带来了希望,他们可能在某天指引肿瘤细胞关闭自己的耐药性。
由马里兰大学帕克分校费舍尔生物工程学系教授Xiaoming "Shawn" He及来自其他五个研究机构的研究人员的新研究开发了一项新技术,可以使用特殊设计的纳米颗粒和近红外光治疗促使肿瘤细胞失去耐药性。这为化疗创造了一个窗口去治疗手术或者早期治疗遗留下来的最耐药的癌细胞。他们的新发现于近日发表在《Nature Communications》上。
“如果在这个治疗窗口内进行化疗,那么肿瘤学家门也许可以用很低剂量的化疗药物进行肿瘤治疗,这有助于改善治疗效果并降低化疗药物对正常组织的毒性。”He说道。肿瘤细胞产生耐药性的主要原因之一是过表达药物外排泵,它们是可以保护细胞的蛋白质,可以将细胞不需要的有毒物质泵出细胞。就像外排泵可以将毒素排出细胞以保护细胞一样,它们也会将几乎所有临床使用的化疗药物泵到胞外。
幸运的是,外排泵需要化学能量才能工作。因此通过切断外排泵的能量来源,肿瘤学家可以降低甚至消除细胞对化疗药物的耐药性。意识到这点后,He及其同事开发了一种新方法降低癌细胞中给外排泵供能的的三磷酸腺苷(ATP)的含量。
该研究团队包括来自俄亥俄州立大学、弗吉尼亚大学、密苏里大学医学院、上海中医药大学和印第安纳大学医学院的研究人员,他们将一种特殊设计的纳米颗粒靶向到了线粒体,线粒体是细胞将氧气和能量转变为ATP的能量供应站。一旦纳米颗粒到达线粒体,研究人员使用近红外光促使纳米颗粒发生化学反应消耗ATP,从而降低其浓度,切断外排泵的能量供应。这种治疗不仅减少了外排泵的表达,同时还减少了它们在细胞膜的分布。
研究团队的发现表明携载药物的纳米颗粒与近红外光联合使用可以有效抑制多药耐药细胞的生长,同时没有明显的系统毒性。尽管研究人员很久之前就使用纳米颗粒输送药物,但是He及其同事提出的方法仍然是克服癌细胞多药耐药的关键突破。
“这么多年来研究人员一直聚焦于使用纳米颗粒输送更多的化疗药物进入癌细胞,但是没有靶向耐药的根源。”He说道。“这意味着癌细胞会继续保持它们将药物排出胞外的能力,这也就限制了化疗的效果。为了解决这个挑战,我们研究小组不仅使用纳米颗粒输送化疗药物到肿瘤细胞内的靶向部位,同时还抑制了外排泵的功能,因此显著提高了化疗的安全性和疗效。”
【4】Ann Oncol:克服乳腺癌耐药将不是梦!研究人员发现导致ER+乳腺癌耐药的基因突变!
DOI:https://doi.org/10.1093/annonc/mdy025
在美国匹兹堡大学马吉妇科研究所(MWRI)和UPMC希尔曼癌症研究中心,一大群致力于研究最常见乳腺癌耐药机制的临床医生和实验研究人员发现了雌激素受体(ER)上的一个新突变会导致耐药性。ER+乳腺癌占乳腺癌病例的2/3,由体内的雌激素提供能量生长。抗雌激素疗法在治疗初期通常有效,但是ER+乳腺癌却通常会由于肿瘤产生耐药性而复发。
在一项最新发表在《Annals of Oncology》上的研究中,研究人员发现耐药肿瘤组织中出现了ER基因ESR1融合蛋白。这是首次在人乳腺癌组织中发现ESR1融合蛋白,探索它们发挥功能的方式将改善这种癌症的治疗。
“我们在一个患有ER+乳腺癌、接受抗雌激素疗法并复发去世的病人身上发现了这个改变。”通讯作者、MWRI和UMC希尔曼癌症研究中心女性癌症研究中心主任、匹兹堡大学药学和化学生物学教授Adrian Lee博士说道。“我们实验室的一个成员在进行组织基因分析时注意到了这个突变,随着时间延长,我们在许多复发病人体内都发现了这个突变。”这项工作由他们与基因测序公司Foundation Medicine Inc.合作完成,该公司利用他们的FoundationOne CDx测试检测了接近10000乳腺癌病人的ESR1融合情况。
据Lee所说,ESR1融合蛋白可以分解为原来的1一半并清除抗雌激素疗法靶向的结合位点以避开这种治疗。“医生将继续给病人进行抗雌激素治疗,但是并没有意识到已经发生了这个基因突变。”Lee说道。“现在我们知道了这个变化,我们可通过血检检测这个突变,这将帮助改善这种肿瘤的治疗现状。”
“基因测序正在告诉我们更多关于乳腺癌的信息。我相信我们的研究将在不久的将来对临床实践产生巨大影响,我们的工作将为改善病人护理和生存率带来希望。”
【5】Scientific Reports 新型计算方法找出化疗耐药靶标
DOI: 10.1038/s41598-018-19284-3
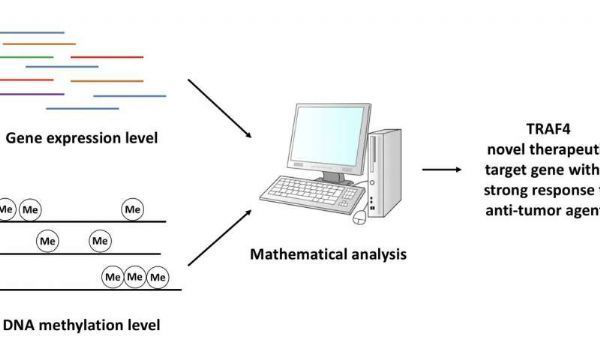
肿瘤最重要的一个特点就是脱氧胞嘧啶甲基化形成5-甲基胞嘧啶(5mC)。DNA甲基化是一个甲基添加到DNA分子上的过程。
目前已经发现5mC的出现和分布对基因调节很重要,它也可以作为诊断的关键生物标记物。因此研究DNA甲基化和转录之间的关系对于揭示细胞反应以及新药开发很重要。
大量的DNA甲基化和转录分析已经产生了大量的数据,但是从中找出和癌症发展相关的关键基因却很困难。为了解决这个问题,来自日本大阪大学的研究人员使用高斯方程将大量的数据转化为平滑函数,从中提取出合适的信息——可以代表5mC甲基化水平的信息。
“肿瘤中包含一种叫做肿瘤干细胞(CSCs)的细胞,它们可以自我更新,具有致癌性,并在化疗和放疗耐药性中发挥着重要作用。”这篇发表在《Science Reports》上的研究的第一作者Masamitsu Konno解释道。“因此我们想通过CSC模式酶鸟氨酸脱羧酶确定胞内5mC的情况,以找到治疗靶标。”
一种新的计算方法将基因表达水平和甲基化修饰数据整合在一起,使得研究人员成功地发现TRAF4是一个重要的化疗耐药基因。通过这种方法,研究人员还确定了几种治疗人胃肠癌(包括食管癌)的药物的效果。已有许多研究报道某些肿瘤(如乳腺、肺部及前列腺肿瘤)中TRAF4表达异常,但是这是首个研究发现TRAF4对于调节人食管癌CSCs功能至关重要。
“我们的数学方法可以同时用于鉴定和定量胃肠癌干细胞中导致化疗耐药的潜在靶标。”通讯作者Yuichiro Doki说道。“我们的结果不仅为针对食管癌靶点的药物开发带来了关键信息,还可以用于大规模筛查CSC药物治疗靶点。”
【6】Nat Commun:科学家发现改善白血病耐药问题的突破点
DOI: 10.1038/s41467-017-01678-y

最近,在一项刊登在国际科学杂志Nature Communications的研究成果中,科学家们发现了在急性髓性白血病中两个蛋白之间的连接如何使肿瘤细胞对化疗产生抵抗,并表示对这一连接进行干扰能使癌细胞更容易受到化疗的攻击。这项由圣犹大儿童研究医院药物科学系John Schuetz博士领导的研究,将有助于开发为急性髓性白血病,结肠癌、乳腺癌和成神经管细胞瘤患者增强化疗疗效的药物。
急性髓性白血病新疗法的开发至关重要,因为这类白血病在成年人和儿童中的5年总体生存率仅为27%。之前有其他科学家发现,在急性髓性白血病侵袭性病例中,一个叫ABCC4的蛋白含量大幅增加。基于这一研究,Schuetz和他的同事试图寻找其它可能与ABCC4相互作用并使其发挥作用的蛋白。他们对数百个备选蛋白进行搜索之后发现,一个叫MPP1的蛋白也在急性髓性白血病中大量增加了。
研究者们表示,这两个蛋白相互连接,并且这一连接使细胞呈现出高度增殖的白血病细胞的特征。在实验中研究者们从遗传学上改造血液祖细胞,使其拥有高水平的MPP1和ABCC4.研究者将这些细胞放在培养基上生长,然后转移或再接种到新的培养基上,来观察细胞是否能够继续生长。这样的自我更新便是白血病细胞的特征。研究者们发现,只有细胞同时具有高水平的ABCC4 和 MPP1时才能连续生长。
"很显然,如果你把正常的祖细胞再接种,你只能成功一次或两次," Schuetz说。"但是,令我们非常惊讶的是,过表达MPP1--类似于在白血病中所见的那样--会使祖细胞自我更新,可以一次又一次地再接种,不断形成新的集落。"
这项实验也揭示,这两个蛋白是在细胞膜上发挥作用的,它们在那里能使癌细胞避开化疗药物。
"当我们破坏它们的互作时,ABCC4便脱离了细胞膜,且细胞变得对白血病药物更加敏感,而这些药物原本会被ABCC4赶出细胞。" Schuetz说。
通过对几千个化合物的检索,研究者们鉴定出了那些可以破坏ABCC4-MPP1连接的分子。一个叫抗霉素A的分子在急性髓性白血病细胞系和患者的细胞中都完全逆转了抗药性。抗霉素A毒性太强,在化疗中无法使用,但对该物质的鉴定应该帮助科学家寻找其他毒性较低的药物来干扰ABCC4-MPP1互作。
该发现也可以使临床医生鉴定出具有高水平ABCC4和 MPP1的患者。干扰ABCC4-MPP1互作的药物能放大化疗的疗效,从而使或将使这些患者受益,Schuetz说。同样,他表示在其它癌症包括乳腺癌、结肠癌和成神经管细胞瘤中也表现出高水平的ABCC4和MPP1.这些癌症的化疗疗效也将被干扰ABCC4-MPP1互作的药物增强。
【7】Nature:重磅!科学家鉴别出多种类型耐药癌细胞或拥有相同的隐蔽弱点
DOI:10.1038/nature24297
日前,一项刊登在国际杂志Nature上的研究报告中,来自加州大学旧金山分校的研究人员通过研究发现一种特殊的基因易损性(基因弱点),其或能帮助肿瘤学家有效清除多种类型的耐药癌细胞,相关研究或为研究人员开发新型疗法来抑制癌症复发提供新的思路。
研究人员通常认为,耐药性的产生是癌症通过遗传进化而产生的,一部分患者机体的癌细胞本身会拥有或产生一些新生突变来促进其抵御疗法作用而得以生存,从而导致新型耐药性肿瘤的产生或复发。早在2010年,来自麻省总医院的研究人员就发现了癌症躲避疗法的一种新型通路,这种通路并不需要产生新的突变,肿瘤中一部分持续细胞(persister cells)会促进肿瘤细胞对药物产生耐受性,随后诱发癌症进展。研究者Matthew Hangauer博士表示,这些持续细胞所扮演的关键角色目前无人知晓,但很多肿瘤学家会告诉你,非遗传性的药物耐受性似乎会在患者身上发生,而且天然高度耐药的细胞或许就会成为解释这一点的强力候选者。2016年研究人员发现,在癌症疗法期间,持续细胞或能扮演肿瘤细胞的残余分子,其会处于休眠状态,而且能够躲过多轮疗法的攻击,最终某些细胞就会进化出传统的遗传抗性,从而导致疾病复发。
为了寻找这些持续细胞的生物学弱点,研究者Hangauer及其同事利用RNA测序技术对未经治疗的乳腺癌细胞系及来自这些细胞的持续细胞(高剂量药物拉帕替尼治疗9天后存活下来的细胞)进行研究,寻找这两类细胞之间基因活性的差异,结果发现,持续细胞在典型的间充质细胞中具有较高的基因活性,但在应对氧化性应激的细胞中某些基因的活性却很低。
此前研究者发现,间质状态下的癌细胞对于铁死亡(Ferroptosis)途径非常敏感,而且通过阻断谷胱甘肽过氧化酶4(GPX4)就能够触发细胞的命运。这项研究中,研究人员通过研究发现,在实验室中,GPX4抑制剂能够选择性地杀灭药物治疗的乳腺癌持续细胞,同时并不会对未治疗的乳腺癌细胞或正常的乳腺细胞产生副作用,随后研究者对诸如黑色素瘤、肺癌及卵巢癌等多种类型的癌症进行了相关研究,在每一种癌症研究中,他们都发现,GPX4抑制剂能够诱发药物治疗的持续细胞出现铁死亡,但对于未经治疗的癌细胞并没有什么影响。
Hangauer说道,GPX4抑制剂能够杀灭多种癌症类型中的持续细胞,如今我们发现,对药物耐受的持续细胞的弱点或许超越了癌症的“血统”,此外这种抑制剂也超越了最初研究人员用来对抗癌症的特殊药物,这就意味着,未来研究人员哟午安个开发出一种通用的策略来消除癌症躲避疗法以及复发的风险。研究者认为,将GPX4抑制剂同靶向肿瘤萎缩的疗法相结合就能够有效消除持续细胞,这或许也能够成为有效抑制多种类型癌症复发的新型策略。
最后研究者表示,本文研究中他们首次鉴别出了多种类型的耐药癌细胞所共享的一种特殊的基因易感性(基因弱点),后期他们将以该基因弱点为靶点开发出有效抑制癌症患者疾病复发,甚至能100%清除癌症患者机体癌细胞的新型靶向性疗法。(生物谷Bioon.com)
文章来源网络,如有侵权,请联系删除。
同类文章排行
- EGFR 阳性 III 期不可切除肺癌治疗进展
- 阿替利珠单抗在中国获批广泛期小细胞肺癌一线治疗三周年
- 中国肺癌靶向治疗新药重要研究进展
- dostarlimab-gxly获批用于治疗dMMR复发或晚期子宫内膜癌
- retifanlimab获批用于转移性或复发性局部晚期默克尔细胞癌
- 晚期前列腺癌PSMA诊疗一体化治疗新格局
- 达拉非尼联合曲美替尼获批!BRAF V600E突变型低级别神经胶质瘤患儿迎来首个全身治疗方案
- 莫博赛替尼为EGFR ex20ins突变NSCLC患者带来生存突破
- 从T-DM1纳入医保,看HER2+乳腺癌规范化诊疗
- 腹膜转移癌拥有光明的未来
最新资讯文章
您的浏览历史








