提到肝癌,专业人士第一反应是“癌症之王”。很多健康人的第一反应或许会是:我不喝酒不抽烟,轮不到我的头上来。然而,事实往往不是那么美好,权威数据显示肝癌在中国的发病量和死亡数都占据了全球半壁以上的江山。
遗憾的是,目前HCC一线治疗方案有限,但幸运的是研究者并未停止脚步,在刚落幕的2018年ESMO大会上公布的GO30140研究终于给学术界带来了期待已久的那束光!美国乔治敦大学隆巴迪综合癌症中心Michael Pishvaian教授口头报告了LBA26,从会场人头攒动的情景就不难看出,学术界对该研究的期待。

我们是有图有真相
一
“癌症之王”的黄昏
肝癌作为癌中之王,一直是各路药厂必争之地。
首先起跑的是索拉非尼,这也是目前全球的一线标准治疗,为口服的多激酶抑制剂,其对总生存(OS)有一定程度的提高(12 个月), 但是缓解率低(≤10%)且毒性大。
历经多年沉寂,仑伐替尼新近获批给学术界带来了欣喜。一项国际III期研究REFLECT显示,仑伐替尼OS非劣效于索拉非尼,最近仑伐替尼在中国获准上市。
免疫疗法如火如荼的今天,这场战役肯定少不了它。有研究显示,单一PD-L1/PD-1 免疫检查点抑制剂在HCC中有令人鼓舞的活性(在之前接受索拉非尼和未接受索拉非尼治疗的患者中),Nivolumab用于晚期HCC一线治疗的客观缓解率(ORR)为23%,可惜目前尚无免疫检查点抑制剂批准用于晚期一线患者。
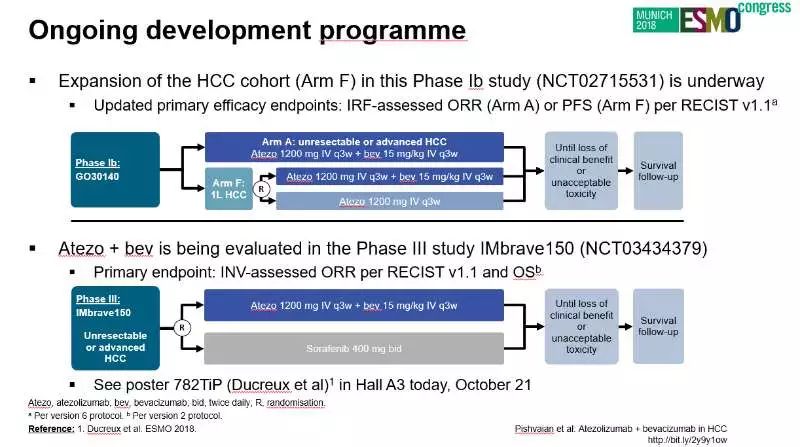
学术界一直期待未来HCC治疗新希望,这就是前面提到的LBA26在ESMO大会上如此轰动的原因。
贝伐珠单抗(抗-VEGF)是一种抗血管生成的抗体,同时具有免疫调节的作用,通过与Atezolizumab联合,贝伐珠单抗可通过逆转VEGF介导的免疫抑制来促进肿瘤中T细胞的浸润,从而进一步加强Atezolizumab的疗效。本次ESMO大会上正式公布Atezolizumab联合贝伐珠单抗治疗肝细胞癌Ib期的研究结果更新数据。

二
解锁HCC治疗新方案
研究设计
A治疗组共计划入组100例未经系统治疗的晚期肝癌患者,接受1200mg Atezolizumab和15mg/kg的贝伐珠单抗,3周一次。着重点为安全性和耐受性,研究者基于RECIST1.1标准评估的ORR。截至2018年7月26日,共有103例接受研究组治疗方案患者安全性可评估,73例患者疗效可评估,至少随访16周。

研究设计:研究对象入组标准、分组及给药方案
研究结果
疗效
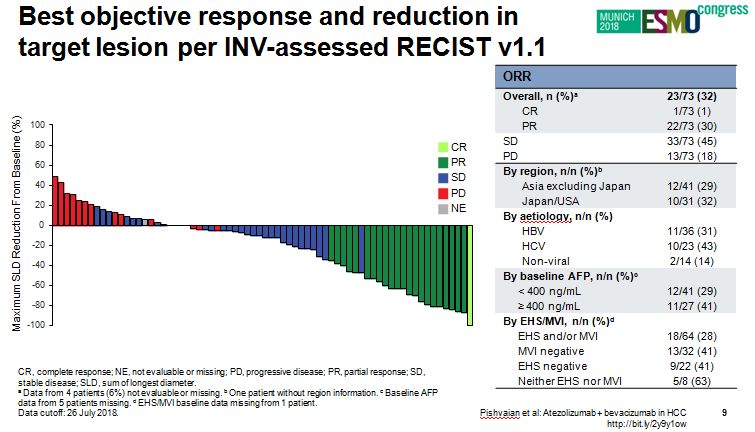
本次大会报告结果显示Atezolizumab+贝伐珠单抗显示用于晚期HCC患者的疗效良好,73例可评估患者,研究者根据RECIST1.1评估有1例达到完全缓解(CR),30例达到部分缓解(PR),确认总体ORR为32%;中位PFS为14.9个月,OS未达到。
基于 RECIST1.1标准由研究者评估的肿瘤ORR
基于 RECIST1.1标准由研究者评估的PFS

而中央独立影像学评估有4例达到CR,16例达到PR,确认总体ORR为27%;所有亚组包括不同基线病因学,地区,基线甲胎蛋白情况,均有缓解病例。患者的缓解是持久的,基于研究者RECIST标准评估,持续缓解超过6个月的患者占52%,缓解超过1年的患者占26%。
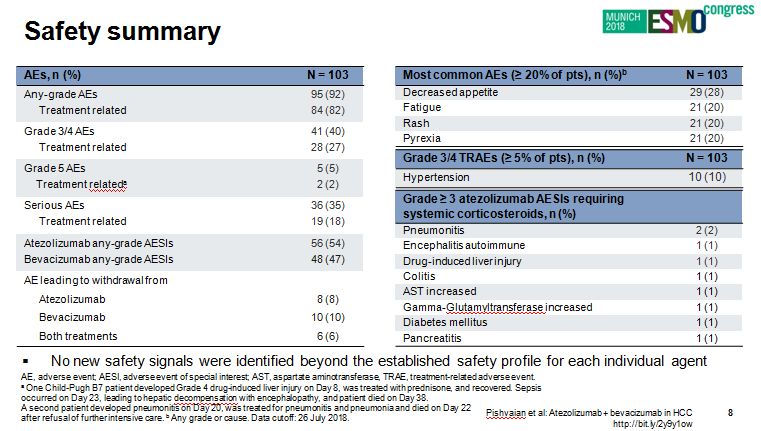
安全性
Atezolizumab+贝伐珠单抗联合方案安全性可耐受,可管理,未发现与已经报道的单药的安全事件的差异。
小结与展望
2018年7月,基于GO30140在2018 ASCO学术年会发布的研究结果, Atezolizumab+贝伐珠单抗一线治疗晚期HCC被美国FDA授予突破性疗法的认定。其良好的安全性与令人鼓舞的缓解率、持续缓解时间和控制疾病进展时间,为晚期HCC患者带来了新的希望!
据悉,本研究的肝细胞癌队列的扩展性研究以及评估Atezolizumab+贝伐珠单抗在晚期肝细胞癌一线治疗的III期研究——IMbrave150研究还将继续开展,希望各家医院和广大医生积极参与随后的研究中,未来能在国内充分扩大研究对象入组(如患者参加临床研究具体可参考CNDA公布的临床研究网站信息)。