6项获批喜讯,涵盖甲状腺癌、子宫内膜癌、实体瘤、骨髓增生异常综合征和急性淋巴细胞白血病多个领域
2024年6月,美国食品药品监督管理局(FDA)批准了肿瘤领域的多款新药和治疗方法。这些新获批的药物和治疗方法为肿瘤患者提供了更多的治疗选择,带来了新的希望。小编汇总目前6月获批新药及适应证,一文速览~
图片来源于网络,侵删
6月6日
FDA批准imetelstat用于低危至中危-1伴输血依赖性贫血的骨髓增生异常综合征。
2024年6月6日,美国食品药品监督管理局(FDA)批准了imetelstat,这是一种寡核苷酸端粒酶抑制剂,用于治疗低危至中危-1骨髓增生异常综合征(MDS)成人患者,这些患者患输血依赖型贫血(需要在8周内输注≥4个红细胞单位),并且对红细胞生成刺激剂(ESA)无应答或失去应答,或者不适合使用ESA。
6月12日
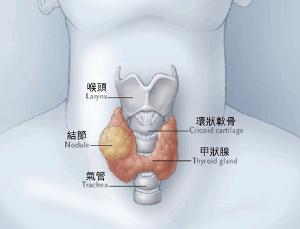
FDA批准塞普替尼用于RET融合阳性甲状腺癌
2024年6月12日,FDA常规批准塞普替尼用于需要全身治疗且放射性碘难治性(如果放射性碘适用)的≥2岁的成人和儿童晚期或转移性RET融合阳性甲状腺癌患者。2020年,塞普替尼被加速批准用于12岁及以上患者的这一适应证。
LIBRETTO-001研究(NCT03157128)是一项多中心、开放标签、多队列临床试验,在单独的队列中纳入65例放射性碘(RAI)难治性(如果RAI是合适的治疗方案)且接受全身治疗的初治和经治RET融合阳性甲状腺癌患者。
主要研究终点为客观缓解率(ORR)和缓解持续时间(DOR)。41例经治患者的ORR为85%(95%CI:71%-94%),中位DOR为26.7个月(95%CI:12.1-不可评估[NE]);24例初治患者的ORR为96%(95%CI:79%-100%),中位DOR为NE(95%CI:42.8-NE)。
支持性证据包括国际、单臂、多队列LIBRETTO-121研究(J2G-OX-JZJJ;NCT03899792)旨在探索塞普替尼治疗儿童和年轻成人晚期RET融合阳性实体瘤患者的疗效和安全性。结果提示,ORR为60%(95%CI:26%-88%),83%患者DOR≥12个月。
常见不良事件(≥25%)为水肿、腹泻、乏力、口干、高血压、腹痛、便秘、皮疹、恶心和头痛。常见的3/4级实验室异常(≥5%)为淋巴细胞减少、丙氨酸转氨酶(ALT)升高、天冬氨酸转氨酶(AST)升高、钠降低和钙降低。
对于2-12岁儿童患者,塞普替尼的推荐剂量是基于体表面积,12岁及以上患者是基于体重。
6月13日
FDA加速批准瑞普替尼用于NTRK基因融合阳性的成人和儿童实体瘤患者
2024年6月13日,FDA加速批准瑞普替尼用于NTRK基因融合的局部晚期、或转移性或手术切除可能导致严重并发症、治疗后疾病进展或无可观的替代疗法的12岁及以上成人和儿童实体瘤患者。
TRIDENT-1研究(NCT03093116)是一项多中心、单臂、开放标签、多队列临床试验,纳入88例经TRK酪氨酸激酶抑制剂(TKI)治疗(n=48)或TKI初治(n=40)的局部晚期或转移性NTRK基因融合阳性实体瘤成人患者。所有患者在基线时均接受了中枢神经(CNS)病灶评估,有症状脑转移的患者被排除。肿瘤评估每8周进行1次。
主要研究终点为根据RECIST v1.1,通过盲态独立中心评估的客观缓解率(ORR)和缓解持续时间(DOR)。TKI初治组患者的ORR为58%(95%CI:41-73),中位DOR为不可评估(NE)(95%CI:NE-NE);TKI经治组为50%(95%CI:35-65),中位DOR为9.9个月(95%CI:7.4-13.0)。
常见不良事件(20%)为头晕、味觉障碍、周围神经病变、便秘、呼吸困难、疲劳、共济失调、认知障碍、肌无力和恶心。
瑞普替尼的推荐剂量为每日1次,每次160mg,口服,用药14日,后增加至每日2次,每次160mg(联合或不联合),直至疾病进展或出现不可耐受毒性。
6月14日
FDA批准度伐利尤单抗联合化疗用于错配修复缺陷的原发性晚期或复发性子宫内膜癌
2024年6月14日,FDA批准度伐利尤单抗联合卡铂和紫杉醇,后度伐利尤单抗单药治疗,用于错配修复缺陷(dMMR)的原发性晚期或复发性子宫内膜癌成人患者。
DUO-E研究(NCT04269200)是一项随机、多中心、双盲、安慰剂对照试验,旨在探索原发性晚期或复发性子宫内膜癌患者中的疗效。肿瘤MMR状态是一个分层因素,并通过肿瘤组织免疫组化检测进行评估。患者随机(1:1:1)入组至以下治疗组之一:
度伐利尤单抗(1120mg)联合卡铂和紫杉醇,每3周1次,最多6周期。化疗完成后,患者每4周接受1次度伐利尤单抗(1500mg)维持治疗,直至疾病进展;
安慰剂联合卡铂和紫杉醇,每3周1次,最多6周期。化疗完成后,患者每4周接受1次安慰剂治疗,直至疾病进展;
另一种试验性联合治疗方案。
主要研究终点为研究者根据RECIST v1.1评估的无进展生存期(PFS)。
虽然与卡铂和紫杉醇单纯化疗相比,度伐利尤单抗联合卡铂和紫杉醇治疗在总体人群中观察到PFS有统计学意义显著改善,但根据肿瘤MMR状态进行的探索性分析显示,总人群的改善主要归因于dMMR肿瘤患者。
在95例dMMR肿瘤患者中,度伐利尤单抗组的中位PFS未达到(NR)(95%CI:NR-NR),而安慰剂组为7个月(95%CI:6.7-14.8)(风险比:0.42,95%CI:0.22-0.80)。总生存期(另一研究终点)在PFS分析时尚不成熟。
度伐利尤单抗联合卡铂和紫杉醇常见不良事件(25%)为周围神经病变、肌肉骨骼疼痛、恶心、脱发、疲劳、腹痛、便秘、皮疹、腹泻、呕吐和咳嗽。
对于体重≥30kg患者,度伐利尤单抗推荐剂量为1120mg,卡铂和紫杉醇,每3周1次,共6周期,后度伐利尤单抗1500mg单药,每4周1次。对于体重<30kg患者,度伐利尤单抗推荐剂量为15mg/kg,卡铂和紫杉醇,每3周1次,共6周期,后度伐利尤单抗20mg/kg单药,每4周1次。
6月14日
FDA批准贝林妥欧单抗作为CD19阳性费城染色体阴性前体B细胞急性淋巴细胞白血病的巩固治疗
2024年6月14日,美国食品药品监督管理局(FDA)批准贝林妥欧单抗(blinatumomab)用于在多期化疗的巩固阶段治疗的CD19阳性费城染色体阴性前体B细胞急性淋巴细胞白血病(ph阴性BCP ALL)的成人、儿童(≥1个月)和老年患者。
6月17日
FDA批准帕博利珠单抗联合化疗用于原发性晚期或复发性子宫内膜癌
2024年6月17日,FDA批准帕博利珠单抗联合卡铂和紫杉醇,后帕博利珠单抗单药治疗原发性晚期或复发性子宫内膜癌成人患者。
KEYNOTE-868/NRG-GY018研究(NCT03914612)是一项多中心、随机、双盲、安慰剂对照试验,共纳入810例晚期或复发性子宫内膜癌患者。本研究根据错配修复(MMR)状态纳入两个单独的队列:错配修复缺陷(dMMR)队列222例患者和错配修复正常(pMMR)队列588例患者。患者随机(1:1)入组至以下治疗组之一:
帕博利珠单抗200mg,每3周1次,紫杉醇175mg/m2和卡铂AUC 5mg/mL/min,共6个周期,后帕博利珠单抗400mg,每6周1次,最多14周期;
安慰剂,每3周1次,紫杉醇175mg/m2和卡铂AUC 5 mg/mL/min,共6个周期,后安慰剂每6周1次,最多14周期。
根据MMR状态、ECOG体能状态(0、1或2分)和既往辅助化疗进行分层。
主要研究终点为研究者根据RECIST 1.1评估的无进展生存期(PFS)。在dMMR队列中,帕博利珠单抗和化疗组中位PFS未达到(NR)(95%CI:30.7-NR),安慰剂组为6.5个月(95%CI:6.4-8.7)(风险比:0.30,95%CI:0.19-0.48,p<0.0001)。在pMMR队列中,帕博利珠单抗和化疗组的中位PFS为11.1个月(95%CI:8.7-13.5),安慰剂组为8.5个月(95%CI:7.2-8.8)(风险比:0.60,95%CI:0.46-0.78,95%CI:0.46-0.78,p<0.0001)。
在安全性方面,除皮疹发生率较高外,与既往报告的安全性事件相似。
帕博利珠单抗的推荐剂量为每3周200mg或每6周400mg,直至疾病进展、不可耐受毒性或最长治疗24个月。
文章摘自网络,侵删
推荐阅读:
同类文章排行
- 6项获批喜讯,涵盖甲状腺癌、子宫内膜癌、实体瘤、骨髓增生异常综合征和急性淋巴细胞白血病多个领域
- 多发性骨髓瘤治疗中的金字招牌——自体造血干细胞移植
- 男子便秘2个月竟查出3处癌
- 免疫治疗时代,中国经验力证G base方案在真实世界安全有效
- EGFR阳性NSCLC靶向治疗临床选择愈发丰富
- 晚期cHL患者基于极早期FDG-PET的适应性治疗
- 奥雷巴替尼3项重磅研究亮相2024 EHA,为Best-in-Class再添有力新证!
- MAIA研究最终分析重磅公布,超7.5年OS支持D-based方案成为NDMM新标准方案!
- 以卡非佐米为基础的化疗方案治疗多发性骨髓瘤,ORR可达84.9%
- 地舒单抗持续应用改善NDMM的骨密度和骨代谢
最新资讯文章
您的浏览历史